溶酶體膜的完整性對細胞的命運至關(guān)重要,一旦溶酶體膜通透性改變,就會(huì )釋放以組織蛋白酶為主的多種水解酶到細胞質(zhì)中,通常會(huì )導致細胞死亡,稱(chēng)為溶酶體依賴(lài)性細胞死亡。目前,有多種機制可解釋溶酶體通透性,包括:(1)線(xiàn)粒體產(chǎn)生的活性氧自由基氧化破壞溶酶體膜完整性;(2)溶酶體內的鞘氨醇在特定條件下富集,調控溶酶體通透性;(3)促凋亡蛋白Bcl-2家族與溶酶體直接相互作用,在溶酶體膜上形成孔道導致組織蛋白酶的釋放;(4)磷酸化的轉錄因子p53可易位到溶酶體膜上誘導溶酶體膜通透性;(5)溶酶體膜蛋白成分的改變誘導溶酶體膜通透性等。
鑒于溶酶體功能在癌細胞中的重要作用,目前,科研人員針對溶酶體開(kāi)發(fā)了多種小分子化合物,這些小分子化合物可誘導溶酶體膜通透性或者干預溶酶體功能來(lái)殺傷腫瘤細胞。例如,氯喹可誘導溶酶體膜通透性來(lái)調節溶酶體功能,從而恢復難治性非小細胞肺癌細胞對順鉑的敏感性;沙利霉素有效隔離溶酶體內的鐵誘導溶酶體膜通透性,從而有效殺死腫瘤細胞。這些發(fā)現表明,對傳統療法不敏感的癌細胞或許可通過(guò)使用激活溶酶體細胞死亡途徑進(jìn)行有效治療。另外,腫瘤細胞溶酶體比正常細胞更脆弱并且更容易發(fā)生溶酶體膜通透性和溶酶體依賴(lài)性細胞死亡。因此,針對溶酶體依賴(lài)性細胞死亡途徑的干預可能是多種類(lèi)型癌癥的有效治療策略。然而,目前我們對溶酶體依賴(lài)細胞死亡的認識才剛剛起步,相關(guān)的分子靶標以及分子機制有待深入研究。
近日,蘇州醫工所生物標志物研究中心在國際頂級期刊Proceedings of the National Academy of Sciences發(fā)表研究論文“LCDR regulates the integrity of lysosomal membrane by hnRNP K-stabilized LAPTM5 transcript and promotes cell survival”,該研究首次報道調控溶酶體介導細胞死亡的表觀(guān)轉錄調控新分子,并詳細闡明了調控機制以及臨床意義,為腫瘤生物標志物的開(kāi)發(fā)與臨床靶向治療提供新的理論基礎。
首先,研究者系統性整合分析了組蛋白乙酰化調控以及癌癥基因組圖譜數據庫差異表達的基因,發(fā)現一個(gè)全新的溶酶體細胞死亡調節(lysosome cell death regulator, LCDR)基因在肺癌中顯著(zhù)高表達且受到組蛋白乙酰化的調控。接著(zhù),為了研究LCDR的生物學(xué)功能,研究者在肺癌細胞中敲減LCDR進(jìn)行實(shí)驗,敲減 LCDR 顯著(zhù)降低細胞的增殖以及克隆形成能力,并誘導了細胞凋亡。同樣地,小鼠皮下移植瘤實(shí)驗顯示出一致的結果。隨后,為了進(jìn)一步闡明LCDR調控的信號通路,研究者通過(guò)RNA下拉、轉錄組測序及RNA結合蛋白免疫沉淀等實(shí)驗證實(shí),LCDR 通過(guò)與核內不均一核糖核蛋白 K (heterogeneous nuclear ribonucleoprotein k, hnRNP K) 的KH1結構域相互結合,促進(jìn) hnRNP K蛋白的KH3結構域與溶酶體跨膜蛋白 5( lysosomal protein transmembrane 5, LAPTM5)的3′末端非翻譯區相互結合,并提高了 LAPTM5 的穩定性,維持了溶酶體膜的穩定性,從而抑制溶酶體依賴(lài)性細胞死亡,促進(jìn)細胞生存。
眾所周知,組蛋白乙酰化修飾是表觀(guān)遺傳的重要調控方式,其復雜而精準地調控基因表達,在腫瘤的發(fā)生與發(fā)展過(guò)程中發(fā)揮著(zhù)重要的作用。靶向組蛋白去乙酰化酶是癌癥治療中一種很有前景的治療策略,然而,臨床前證據表明,靶向組蛋白去乙酰化酶的單一藥物在癌癥患者治療中僅具有中等療效,這可能由于靶向組蛋白去乙酰化酶藥物同時(shí)影響了二級信號通路。本文中研究者系統性鑒定了組蛋白乙酰化調控的基因表達譜,并發(fā)現組蛋白去乙酰化酶抑制劑可以顯著(zhù)誘導LCDR 的表達并通過(guò)維持溶酶體的完整性促進(jìn)癌細胞存活,這可能是導致乙酰化酶藥物不良效果的部分原因。因此靶向組蛋白去乙酰化酶和LCDR的聯(lián)合治療可能對部分患者具有更佳的療效,為患者的治療提供新的思路。
此外研究表明LCDR,hnRNPK和LAPTM5的表達量顯著(zhù)高于癌旁組織, LCDR與hnRNP K以及LAPTM5的表達量存在顯著(zhù)的相關(guān)性,且LCDR/hnRNP K/LAPTM5受試者工作曲線(xiàn)聯(lián)合分析顯示出更高的靈敏度以及特異性。同時(shí),研究者開(kāi)發(fā)了核靶向性的納米材料遞送si-LCDR,并使用患者來(lái)源異種移植小鼠模型鑒定了LCDR作為臨床靶標的可行性。
綜上所述,研究者首次鑒定了一個(gè)全新的表觀(guān)轉錄調控新分子在轉錄后水平調控溶酶體依賴(lài)性細胞死亡(圖1),并揭示了一個(gè)全新的LCDR/hnRNP K /LAPTM5軸調控肺癌的發(fā)生與發(fā)展,這些發(fā)現為癌癥的治療提供了一個(gè)很有前景的策略。
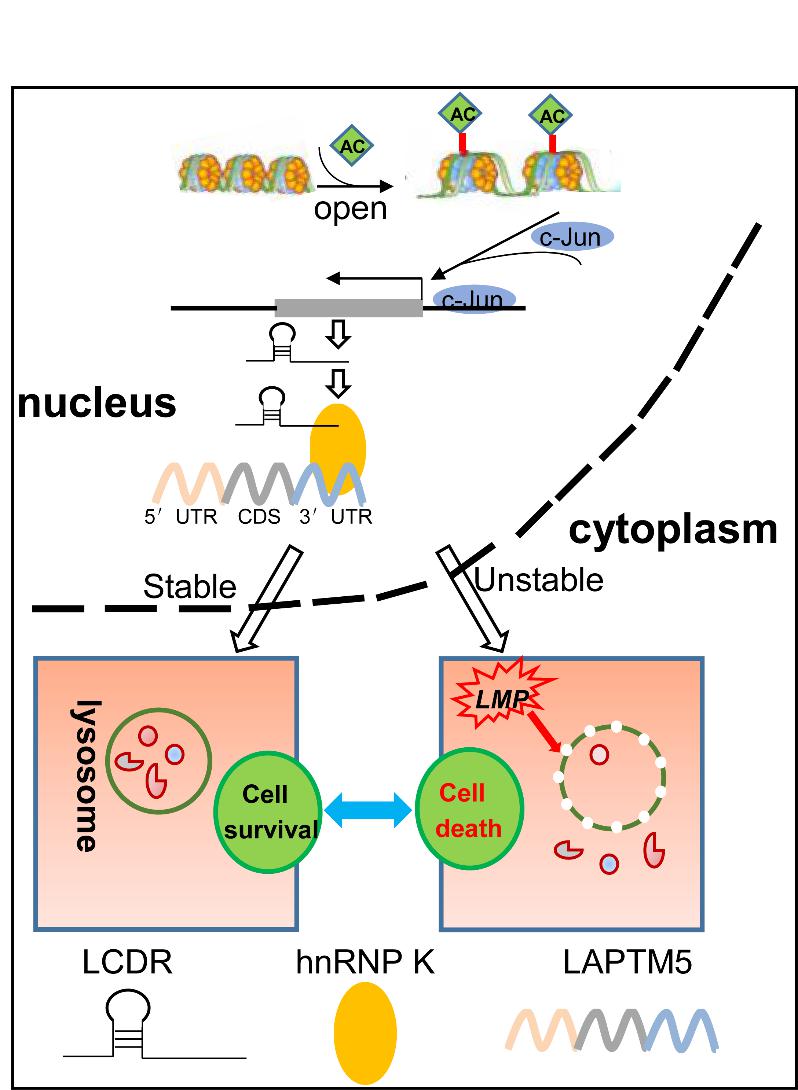
圖1 LCDR/hnRNP K/LAPTM5調控模式圖
據悉,本文的最后通訊作者是高山研究員。該工作得到了國家自然科學(xué)基金、中科院戰略先導等項目的支持。